يقدم لكم موقع إقرأ في هذا المقال مقدمة بحث كيمياء عن حالات المادة ، و بحث عن حالات المادة الصلبة والسائلة والغازية ، و تحولات المادة ، و مكونات المادة ، و خصائص المادة ، حرصاً من الموقع على تقديم كل الأبحاث العلمية المفيدة في شتى المجالات المختلفة، فتابعوا معنا.
مقدمة بحث كيمياء عن حالات المادة
تشير كلمة مادة إلى جميع الأشياء الموجودة في الكون، والتي لها كتلة، وتستهلك مساحة، وتتكون كل مادة من مجموعة من الذرات يتم تصنيف المادة على أساس قربها من بعض وترابطها، حيث إن المادة الصلبة تتميز بقوتها، والحفاظ على شكلها وحجمها، وتتميز المادة السائلة بالحفاظ على حجمها دون الحفاظ على شكلها، أما المادة الغازية فهي المادة التي لا تحافظ لا على شكلها ولا على حجمها، وحسب نصوص الكيمياء التمهيدية فإنه يتم تصنيف حالات المادة على أنهم ثلاث وهم الصلبة، والسائلة، والغازية، بينما النصوص المتقدمة تعمل على تصنيفها على أنها أربعة حالات، وذلك بإضافة حالة البلازما إلى الحالات السابقة، وتتشابه صفات البلازما بصفات الغاز، حيث إن شكلها وحجمها يتغيران، إلا أنها بالإضافة إلى ذلك تغير شحنتها الكهربائية.
بحث عن حالات المادة الصلبة والسائلة والغازية
الحالة الصلبة
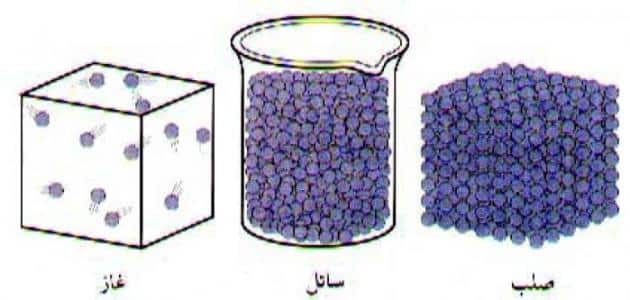
تحتفظ المادة الصلبة بحجم وشكل ثابتين، حيث إنها تتكون من جسيمات متراصة بشكل كبير، مما يجعلها غير قادرة على الحركة إلا بشكل بسيط جداً، حيث تقتصر حركتها على اهتزاز بسيط للذرات في مكانها ناتج عن حركة الإلكترونات، لذلك عندما يتم وضع المادة الصلبة في وعاء فإنها لا تأخذ شكل الوعاء ولا حجمه، ولو تم ضغط المادة الصلبة بإحكام في وعاء؛ فإن حجمها لن يتغير أبداً تحت أي ظرف.
الحالة السائلة
يتم تعريف المادة السائلة على أنها تلك المادة التي تحتفظ بحجمها دون الاحتفاظ بشكلها، حيث إنه عندما يتم سكب المادة السائلة في وعاء؛ فإنها تأخذ شكله مع الاحتفاظ بحجمها طالما لم تحدث عملية التبخر، وتعتبر هذه الخصائص بمثابة معايير يتم من خلالها تمييز المادة السائلة عن باقي المواد كالصلبة والغازية، فالمادة الصلبة تحتفظ بحجم وشكل ثابتين، بينما المادة الغازية لا تحتفظ لا بشكل ولا بحجم ثابتين.
الحالة الغازية
تتميز المادة الغازية بوجود مسافات كبيرة بين جسيماتها، واحتوائها على طاقة حركية كبيرة، لذلك إن لم يتم احتجازها في وعاء فإنها ستنتشر إلى ما لا نهاية، بينما إن تم وضع الغاز في وعاء فإنه سينتشر في جميع أجزاء الوعاء، ويمكن ضغط الغاز عن طريق خفض حجم الوعاء، حيث يؤدي ذلك إلى تقليل المسافات بين أجزاء الغاز، مما يزيد من الاصطدامات التي تحدث بينها، كما يمكن زيادة الضغط من خلال رفع درجة الحرارة، وتحتوي جزيئات الغاز على طاقة حركية كبيرة تمكنها من التغلب على قوة ترابط الجزيئات، ونتيجةً لذلك فإن المادة الغازية لا تحتوي لا على شكل ولا على حجم ثابت.
تحولات المادة
يعتبر المسبب الأساسي لتحوّلات المادة من حالة لأخرى هي امتلاكها أو إطلاقها للطاقة، حيث أن الطاقة الكامنة المختزنة بداخل الأجسام لاتختفي بل تتحوّل من شكل لآخر ومن جسم لآخر، إذ تتحوّل المادة من حالةٍ لأخرى عبر عدّة مراحل انتقالية لتكوين الحالات الرئيسيّة الثلاث وهي الصلبة، السائلة والغازيّة، ويمكن ذكرها على النحو التالي:
الذوبان
هو انتقال المادة من الحالة الصلبة إلى الحالة السائلة، ويتم عادةً عند تسخين المواد ورفع درجة حرارتها مما يكسب الجزيئات حرارة ويزيد من طاقتها الحركيّة.
التجمّد
هو انتقال المادّة من الحالة السائلة إلى الحالة الصلبة، عند خفض درجة حرارتها.
التبخّر
هو انتقال المادّة من الحالة السائلة للغازيّة عند رفع درجة حرارتها، عبر مرورها بدرجة الغليان، وهي الدرجة التي يتبخّر عندها السائل.
التكثيف
التكثيف هي عمليّة تحويل المادة من الحالة الغازيّة للسائلة عبر تطبيق ضغط عليها.
التسامي
هي عمليّة تحول المادة الصلبة إلى غازيّة، دون المرور بالحالة السائلة، وتحدث عندما تكون طاقة الذرات الحركيّة أكبر من الضغط المطبق عليها.
الترسيب
هي تحول المادة من غازيّة إلى صلبة دون المرور بالحالة السائلة، مثل تحوّل بخار الماء إلى صقيع غي درجات الحرارة المنخفضة.
قد يهمك:
مكونات المادة
إنَّ فكرة أنَّ المادّة مُكوّنة من جُسَيمات صغيرة تُسمّى ذرّات قد نشأت منذ القرن الخامس قبل الميلاد على يد الفَيْلسوفَيْن اليونانيين ديموقريطوس وليوكيبوس. تُعتَبَر ذرّة الهيدروجين هي أبسط انواع الذرّات؛ حيثُ تحتوي على بروتون واحد فقط.
إنَّ البروتونات والنيترونات والإلكترونات تتكوَّن من الفرميونات (بالإنجليزيّة: Fermion)، ويُوجَد تصنيفين من الأخيرة، وهي الكوارك، والليبتون؛ حيث إنّهما لا تُعتبران نوع من أنواع المادّة. الموادّ المضادّة (بالإنجليزيّة: Antimatter) هي أيضاً نوع من أنواع المادّة، حتّى وإن كانت جُزيئاتُهما تَمْحق المادّة الطبيعيّة عند تلامسهم.
خصائص المادة
لكل مادة خصائص فيزيائية وكيميائية تميزها عن غيرها من المواد، وفيما يلي توضيح كل من تلك الخصائص:
الخصائص الفيزيائية للمادة
هي خصائص المادة التي لا يؤثّر تغيّرها على تركيبة المادة الأصلية، والتي يمكن قياسها دون الحاجة إلى وجود تفاعل مثل الكثافة واللون، أو التي تُقاس من خلال تغيرها تحت ظروف الحرارة، مثل الانصهار والتجمد.
وتلاحظ التغيرات الفيزيائية في حياتنا اليومية؛ كذوبان الشمع، وذوبان السكر في القهوة، وطحن المواد الصلبة إلى مساحيق، فيكون التغيير في الحالة الفيزيائية للمادة، ولكن دون التأثير في تركيبها الكيميائي، ومن تلك الخصائص الفيزيائية:
- كتلة المادة وحجمها.
- اللون.
- الكثافة.
- الصلابة.
- نقطة الانصهار، والتي يتحول عندها شكل المادة إلى السائلة.
- نقطة الغليان، والتي يبدأ بعدها السائل بالتبخر.
الخصائص الكيميائية للمادة
هي خصائص المادة التي تصف التغيرات في تركيبتها، إذ ينتج عن تفاعل المادة مع غيرها نوع جديد يختلف عن تركيبة المواد المتفاعلة، فمثلاً يعد الصدأ تغيراً كيميائياً؛ إذ إن مادة الصدأ مختلفة عن الحديد والماء الموجودين قبل التفاعل، وكذلك جميع أشكال الاحتراق، والطعام الذي يتم طهيه أو هضمه أو تعفنه.
ولتحديد خاصية المادة الكيميائية، يُدرس التغير الحاصل للمادة عند التفاعل؛ أو تحولها إلى نوع مختلف عن تركيبتها الأصلية، ومن تلك الخصائص الكيميائية:
- قابلية المادة للاشتعال أوالانفجار.
- قدرة المعادن على التفاعل مع الحمض.
- تفاعل المادة مع الأكسجين لتكوين الأكاسيد.
- التآكل.
- التعفّن.
- التحلّل.
- التخمّر.